 |
|
||||
Стоматологическое
|
Применение гиалуроновой кислоты в комплексном лечении заболеваний пародонта
Л.Ю. Орехова, д. м. н., профессор, зав. кафедрой
Е.С. Лобода, к. м. н., доцент
Н.А. Яманидзе, ассистент
А.Р. Галеева, студент
Кафедра стоматологии терапевтической и пародонтологии
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени акад. И. П. Павлова»
Минздрава РФ
Научно-практический журнал для стоматологов "Пародонтология" №3 (88) 2018
Резюме
В последние годы в медицине, и в стоматологии в частности, довольно широкое распространение получили препараты гиалуроновой кислоты (ГК), что связано с большим числом важных биологических функций, в которых она задействована: участие в процессах миграции, пролиферации и дифференцировке клеток, регенерации и поддержание водного баланса тканей, участие в ряде взаимодействий с поверхностными рецепторами клеток, обеспечение необходимой вязкости синовиальной жидкости, упругости суставных хрящей, участие в системе врожденного иммунитета.
Ключевые слова: гиалуроновая кислота, заболевания пародонта, хронический генерализованный пародонтит.
Гиалуроновая кислота является гидрофильным полимером и характеризуется высокой сорбционной способностью к молекулам воды. В присутствии воды ГК образует упругие и в то же время эластичные (мягкие) гели, связывая при этом до 10 000-кратный объем жидкости. Являясь высокомолекулярным гликозаминогликаном внеклеточного матрикса, ГК присутствует в составе соединительной
ткани эмбриональной мезенхимы, стекловидного тела, кожи, в различных жидкостях организма, таких как синовиальная жидкость, сыворотка, слюна и жидкость десневой борозды (GCF) [18]. Состоит ГК из дисахаридных звеньев, соединенных поочередно.. 1, 4- и.. 1, 3-гликозидными связями [10]. Кислота всегда химически идентична, независимо от источника выделения, и различается только
молекулярной массой: низкой молекулярной массой (lmw), около 105–107 Да (3–5 повторяющихся дисахаридных остатков), средней (промежуточной) и высокой молекулярной массой (hmw) до 25 000 (и более) повторяющихся дисахаридных остатков [18].
Она обладает различными физиологическими и структурными функциями, которые включают клеточные и внеклеточные взаимодействия, взаимодействия с факторами роста и регулированием осмотического давления.
Все эти функции помогают в поддержании структурной и гомеостатической целостности ткани. Трофическая, барьерная, пластическая функции соединительной ткани обеспечиваются физико-химическими свойствами ГК, такими как высокая вязкость, специфическая способность связывать воду и белки и образовывать протеогликановые агрегаты [11]. Перечисленные выше свойства ГК важны
для регенерации тканей пародонта и слизистой оболочки полости рта.
Короткие цепи ГК стимулируют ангиогенез (ММ 400–10 000 Да), миграцию клеток и их пролиферацию (ММ 50 000–100 000), тогда как высокомолекулярная ГК (ММ > 500 000 Да) вызывает противоположный эффект, подавляя ангиогенез, ингибируя клеточную миграцию
и пролиферацию [9]. Поэтому для достижения различных целей используются фракции ГК со строго определенной молекулярной массой. Также установлено, что высокомолекулярная ГК обладает противовоспалительным действием, в то время как низкомолекулярная ГК обусловливает обеспечение провоспалительного эффекта высокомолекулярной ГК. Стимулируя генерацию целого комплекса факторов воспаления, низкомолекулярная ГК способствует экспрессии гиалуронатсинтазы, что ведет к накоплению в очаге повреждения высокомолекулярная ГК. Таким образом, ГК выступает модулятором воспаления, как острого, так и хронического [13]. ГК на самых начальных стадиях воспалительного процесса ГК блокирует каскад арахидоновой кислоты, при этом не нарушается синтез жизненно важных простагландинов с протекторным действием [19], активирует ингибиторы металопротеиназ и, таким образом,
эффективно противодействует разрушению тканей.
Подобный эффект достигается путем замедления продукции цитокинов, которые вызывают воспаления (например, TNF.). Тем образом ГК может способствовать сохранению тканей, повреждаемых при воспалении.
По данным Becker et al., благодаря бактериостатическому эффекту, в частности воздействию на микроорганизмы в тканях пародонта, такие как A. actionomyecetemcomitans, Prevotella intermedia и др., ГК обеспечивает биологическую защиту после проведения профессиональной гигиены и при хирургическом лечении патологии пародонта.
ГК вызывает активизацию фибробластов, которые продуцируют коллагеновые волокна, кроме этого, стимулируют производство цитокинов фибробластами, кератиноцитами, цементобластами, остеобластами, следовательно, стимулируют синтез эндогенной ГК эндотелиальными клетками [19]. ГК участвует в процессах миграции, пролиферации и дифференцировке клеток. Хорошие клинические
результаты были получены при использовании ГК при лечении повреждений мягких тканей [17].
Человек рождается с большим количеством ГК в организме, но с возрастом ее уровень значительно уменьшается.
Примерно с 22 лет выработка кислоты замедляется, хотя до 30 лет ее количества еще вполне достаточно для удовлетворения всех потребностей организма. Далее организм начинает испытывать недостаток этого вещества, а после достижения возрастной отметки 40 лет процесс убывания ГК из организма ускоряется в геометрической прогрессии, к 50-летнему возрасту ее количество снижается вдвое. Уменьшение уровня синтеза ГК может быть не только результатом возрастных изменений, но и связано с наличием вредных привычек, плохой экологией, частыми стрессами, нарушением водного режима, работой с компьютерами и др. Перечисленные факторы,
вызывая дефицит ГК, способны привести к замедлению обменных процессов в организме, истончению кожного покрова и слизистых оболочек, в том числе в полости рта, ослаблению местного иммунитета, разрушению хрящевой ткани и появлению возрастных трансформаций.
Современное производство ГК проводят в условиях постоянного бактериологического контроля, обеспечивающего высокое качество получаемого продукта. В последнее время ГК все чаще получают с использованием растительного сырья (пшеничный субстрат) и бактериальных культур (Streptococcus zooepidemicus или Streptococcus equi).
Для увеличения химической, ферментативной и механической устойчивости в препаратах ГК используется сшивание ее макромолекул. Так, гидрогели химически модифицированной ГК, в отличие от нативной, являются гидрофильными сшитыми полимерами, которые способны набухать в воде и формировать нерастворимую объемную структуру. Функции гидрогелей зависят от их структуры.
Степень сшивки определяется природой полимера и средней массой полимерной цепи между узлами сшивки.
Плотность сшивок напрямую влияет на другие фундаментальные свойства гидрогелей, такие как степень набухания,
механическую прочность и эластичность, проницаемость и диффузию. Большое внимание сфокусировано на изучении
гидрогелей на основе ГК для локального или контролируемого высвобождения молекул в органах-мишенях.
В зависимости от концентрации ГК, рН раствора, типа буфера, природы и количества препарата, а также сшивающего
агента может быть получен широкий спектр материалов ГК.
В организме химически модифицированная ГК подвергается деградации с меньшей скоростью в отличие от нативной ГК. В то же время гидрогели сохраняют биосовместимость природной ГК, обладают минимальной токсичностью и иммуногенным потенциалом или не имеют
их вовсе [9].
Наиболее распространенным в стоматологии является применение препаратов ГК в виде инъекций в составе противовоспалительной терапии в комплексном лечении ВЗП, а также для коррекции и устранения дефектов десневых сосочков, прилегающих к зубам или дентальным имплантатам, уменьшения расстояния между промежуточной частью мостовидного протеза и слизистой оболочкой,
покрывающей альвеолярный отросток, а также при отсутствии десневого сосочка (Becker et al., 2009).
В Российской Федерации зарегистрированы формы ГК для специализированного применения в стоматологии, под названиями «Имплантат для стоматологии вязкоэластичный стерильный в шприцах в двух модификациях: Ревидент и Ревидент+ по ТУ 9398-001-63949047-2013» (Регистрационное удостоверение № РЗН 2016/3617 от 06:06.2018 г.), производимые ООО «СЛС» (Россия).
Ревидент – это гиалуроновый инъекционный гель, имплантат для стоматологии, способствующий процессу естественного обновления барьерной, трофической, пластической, опорно-удерживающей функций тканей пародонта.
Содержит высокомолекулярную (до 3, 3 МДа) нативную ГК 1%. Ревидент+ – гиалуроновый имплантат для стоматологии вязкоэластичный, используется для заполнения пародонтальных карманов, восстановления дефицита объема тканей десны и пародонта. Содержит высокомолекулярную перекрестно-сшитую ГК (до 80 МДа) 2%. Линейные молекулы гиалуроновой кислоты соединены сшивающим агентом BDDE между собой через кислородные мостики, образуя жесткую трехмерную структуру.
В представленной в статье исследовательской работе использовался стоматологический гиалуроновый гель Revident (Регистрационное удостоверение № РЗН 2016/3617 06:06.2018 г.), ООО «СЛС».

Рис. 1. Гель гиалуроновый стоматологический Revident
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение эффективности применения препарата ГК в комплексном лечении заболеваний пародонта.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании участвовали 30 пациентов без тяжелой соматической патологии, с диагнозом «пародонтит легкой степени тяжести», которые в последующем были разделены на две равные группы по 15 человек: контрольную и основную. Пациенты были проинформированы о методах предстоящего обследования и последующего лечения, на что были получены письменные информированные согласия. Стоматологическое обследование каждого пациента перед проведением комплексного лечения включало:
опрос, внешний осмотр, осмотр полости рта, оценка состояния слизистой оболочки полости рта и тканей пародонта, определение пародонтальных (PMA, BOP) и гигиенических индексов (OHI-s, Silness, Loe), рентгенологическое исследование, с целью возможности оценки как степени поражения костной ткани, так и характера, стадии и тяжести патологического процесса, а также фотопротокол.
Пациентам обеих групп проводилась профессиональная гигиена полости рта и коррекция индивидуальной гигиены с последующей общепринятой противовоспалительной терапией (в зависимости от клинического состояния).
Первой группе пациентов дополнительно было проведено двукратное инъекционное введение стоматологического инъекционного геля ГК Revident (Регистрационное удостоверение № РЗН 2016/3617 от 06:06.2018 г.), содержание высокомолекулярной (до 3, 3 МДа) нативной ГК 1%, с временным промежутком одна неделя: непосредственно после проведения профессиональной гигиены полости рта и, соответственно, через одну неделю. Протокол трехшаговой методики введения препарата:
A. Препарат Revident вводится иглой под углом 30 градусов срезом иглы вверх под слизистую оболочку альвеолярного отростка по переходной складке на глубину 5 мм и подается в ткани на ретроградном выведении иглы в количестве не более 0, 1 мл.
B. Препарат Revident вводится иглой срезом вверх под углом 45 градусов под слизистую оболочку альвеолярного отростка, на расстоянии, равноудаленном от переходной складки и межзубного сосочка.
C. Препарат Revident вводится иглой срезом вверх под углом 45 градусов под слизистую оболочку альвеолярного отростка в область десневого сосочка.
В качестве дополнительного метода обследования была проведена ультразвуковая доплерография сосудов пародонта. Исследование состояния микроциркуляторного русла пародонта проводилось на специализированном портативном ультразвуковом приборе отечественного производства «Минимакс-Допплер-К». При регистрации микроциркуляторных показателей тканей пародонта
датчик с частотой сигнала 25 МГц располагали на границе между прикрепленной десной и переходной складкой в области всех зубов верхней и нижней челюстей.
Состояние кровотока определялось по данным спектрального анализа допплеровского сигнала в программе Minimax Doppler.2, 1..
Полученные в ходе исследования данные ультразвуковой доплерограммы оценивались с учетом качественных и количественных характеристик.
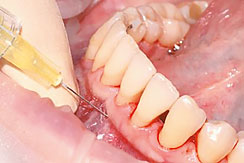
Рис. 2. Введение препарата Revident под слизистую оболочку альвеолярного отростка по переходной складке
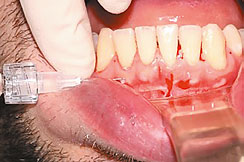
Рис. 3. Введение препарата Revident под слизистую оболочку альвеолярного отростка, на расстоянии, равноудаленном от переходной складки и межзубного сосочка
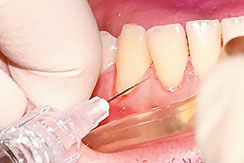
Рис. 4. Введение препарата Revident под слизистую оболочку альвеолярного отростка в область десневого сосочка
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При клиническом осмотре пациентов отмечено: уменьшение отечности и гиперемии десен, улучшение показателей индексов PMA и BOP, улучшение скоростных показателей кровотока, по данным ультразвуковой доплерографии сосудов пародонта. Первая группа пациентов имеет уровень исследуемых показателей выше, чем во второй группе. Анкетирование показало, что пациенты ощущают улучшение состояния десен и отсутствие болевых ощущений.
По результатам внутригруппового анализа в обеих группах наблюдалось достоверное изменение показателей индексов гигиены (ОНI-s) и индекса кровоточивости (BOP).
Показатели гигиенического состояния полости рта (ОНI-s) до начала лечения в 1-й группе составлял 2, 3 балла, во 2-й группе — 2 балла, следовательно, гигиена полости рта оценивалась как неудовлетворительная. Через один месяц после проведенного лечения этот показатель составил в 1-й группе — 0, 6 (хороший уровень гигиены полости рта), а во 2-й группе — 0, 9 (уровень гигиены в удовлетворительных пределах) (рис. 5).
Показатель индекса кровоточивости (BOP) уже через неделю после лечения в 1-й группе составил 23% при исходном показателе 57%, а через 1 месяц — 19%, тогда как аналогичный показатель во 2-й группе через неделю после лечения составлял 34% при исходных 54%, а через 1 месяц — 23% (рис. 6).
По данным межгруппового анализа, в 1-й группе были получены достоверные отличия значений всех представленных на рисунке индексов по сравнению со 2-й группой. Это свидетельствует о более выраженном клиническом эффекте при введении ГК в схему комплексного лечения воспалительных заболеваний пародонта.
Показатель индекса PMA в 1-й группе до начала исследования составил 45%, а через 1 месяц после лечения — 15%, тогда как во 2-й группе при исходном значении индекса 42% через 1 месяц аналогичный показатель составил 25%.
По данным анализа, у пациентов 1-й группы наблюдалась редукция индекса PMA при исходном уровне OHI-s в среднем, равном 2 (3) ± 0, 1 на 30%. В 2-й группе аналогичный показатель был ниже на 10% (рис. 7).
Полученные данные указывают на то, что при применении ГК формируются новые условия, приводящие к улучшению уровня гигиены полости рта. ГК оказывает выраженную противовоспалительную эффективность.
Анализ кривой скорости кровотока включает качественную и количественную оценки. Качественная характеристика кривой доплерограммы в норме меняется в зависимости от вида и калибра сосуда. Смешанный кровоток характеризуется волнообразной картиной окрашенного спектра без острых пиков.
Наиболее значимым диагностическим критерием микроциркуляторных расстройств в тканях пародонта является параметр гемодинамики средняя линейная скорость кровотока (Vam), позволяющий определить степень нарушений и тяжесть течения патологического
процесса в пародонте.
Исходные значения показателя (Vam) в 1-й и 2-й группе оказались практически на одном уровне (составили 0, 53 см/сек. и 0, 52 см/сек. соответственно), а через неделю после проведенного лечения показатель составил: в 1-й группе — 0, 78 см/сек., во 2-й группе — 0, 61 см/сек.
Через 1 месяц после лечения показатель линейной скорости кровотока в 1-й группе сохранял стабильно высокое значение и составил 0, 75 см/сек., тогда как во 2-й группе аналогичный показатель стремился к исходному значению и составил 0, 59 см/сек. (рис. 8).
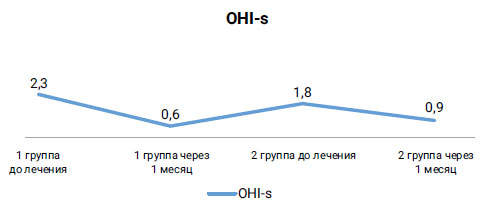
Рис. 5. Оценка изменения уровня гигиены полости рта при оценке показателя OHi-S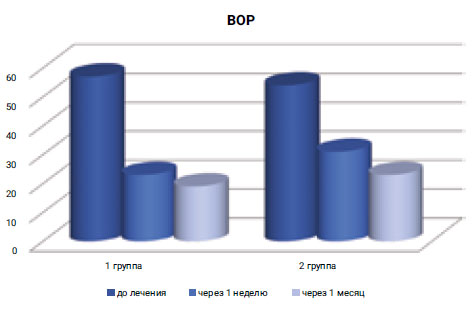
Рис. 6. Оценка изменения индекса кровоточивости BOP (%)
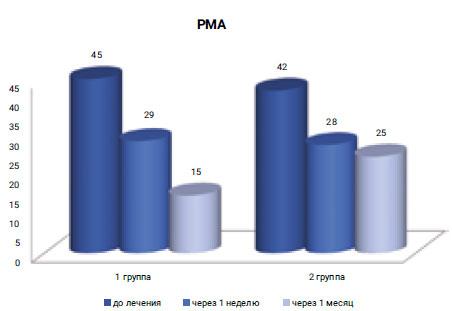
Рис. 7. Оценка противовоспалительного действия по редукции индекса PMA (%)
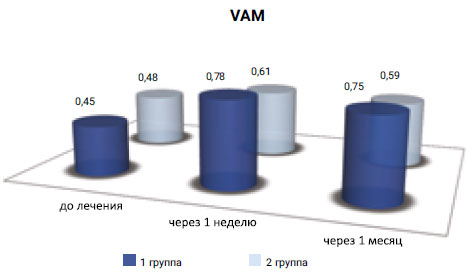
Рис. 8. Оценка динамики показателей средней линейной скорости кровотока (Vam)
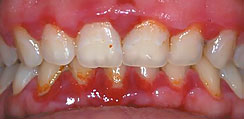
Рис. 9. Пациентка K, 25 лет. Хронический генерализованный пародонтит легкой степени тяжести, обострение, до лечения
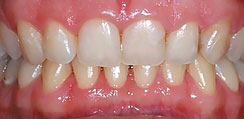
Рис. 10. Пациентка K, 25 лет. Хронический генерализованный пародонтит легкой степени тяжести, ремиссия, через 1 месяц после лечения
Как видно из данных, представленных на гистограмме, в наших исследованиях отмечалось достоверное увеличение линейной скорости кровотока (Vam) у пациентов в обеих группах. Однако динамика повышения показателя в 1-й группе была больше.
На протяжении всего исследования, с целью выявления аллергического или местнораздражающего действия
препарата Revident, у пациентов проводился осмотр состояния слизистой оболочки полости рта, слизистой десневого края, языка, губ.
Результаты регулярных обследований всех участников не выявили случаев аллергических реакций или их местнораздражающего воздействия на слизистую оболочку полости рта пациентов.
Таким образом, полученные результаты клинического опыта применения стоматологического геля с ГК Revident позволяют сделать заключение о достоверной эффективности его применения в составе комплексного пародонтологического лечения у пациентов с хроническим генерализованным пародонтитом легкой степени тяжести.
У пациентов, которым была выполнена терапия с применением стоматологического геля Revident, содержащего ГК, наступали более ранние сдвиги в субъективных и объективных показателях улучшения пародонтологического здоровья, более быстрая и стойкая редукция воспалительного компонента, отмечено положительное влияние на микроциркуляцию тканей пародонта. Вышеуказанное
позволяет считать перспективным использование препаратов ГК в комплексном лечении воспалительных заболеваний пародонта.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Азнабаев М. Т., Имаева А. Р., Башкатов С. А., Габдрахманова А. Ф. Противовоспалительная активность гиалуроновой кислоты // Эксп.
Клин. Фармакол. 2003. №5. С. 28-29.
2. Волков В. Г. Гиалуроновая кислота и основные направления ее применения в медицине // Вестник новых медицинских технологий.
2001. Т. 8. №1. С. 67-70.
3. Лопатина Д. В., Лобанов С. В. Клинический опыт применения производных гиалуроновой кислоты в комплексном лечении больных с деформирующим артрозом крупных суставов // РМЖ. 2010. №11. С. 756.
4. Морра М., Кассинелли К., Бенедетти Л., Каллегаро Л. Патент РФ №2173563. Способ нанесения на поверхность предметов покрытия на
оснвое гиалуроновой кислоты, ее производных и полусинтетических полимеров.
5. Орехова Л. Ю., Лобода Е. С., Яманидзе Н. А. Совершенствование методов диагностики и лечения воспалительных заболеваний пародонта с использованием различных форм препаратов озона путем оценки микроциркуляции тканей пародонта // Пародонтология. 2018. №1 (86). С. 58-63.
6. Орехова Л. Ю., Косова Е. В., Лукавенко А. А., Чмиленко Я. В., Лобода Е. С., Яманидзе Н. А. Результаты клинических исследований по оценке эффективности лечебно-профилактических программ с зубными пастами и стоматологическими гелями у пациентов с заболеваниями пародонта // Пародонтология. 2017. №1 (82). С. 27-30.
7. Орехова Л. Ю., Атрушкевич В. Г., Михальченко Д. В., Горбачева И. А. Лапина Н. В. Стоматологическое здоровье и полиморбидность: анализ современных подходов к лечению стоматологических заболеваний // Пародонтология. 2017. №3 (83). С. 15-17.
8. Понеделькина И. Ю., Лукина Е. С., Финоков В. Н. Кислые глюкозаминоглюканы и их химическая модификация // Биоорг. хим. 2008. Т. 34. №1. С. 5-28.
9. Сигаева Н. Н., Колесов С. В., Назаров П. В., Вильданова Р. Р., Химическая модификация гиалуроновой кислоты и ее применение в медицине // Вестник башкирского университета. 2012. T. 17 (3). С. 1220-1241.
10. Федорищев И. А. Гиалуроновая кислота: монография. Книга 1. – Тула: ТулГУ, 2011. – 237 с.
11. Халдояниди С. К. Роль гиалуроновой кислоты в регуляции иммуно- и миелопоэза: Автореф. дис. … д-ра мед. наук. – Новосибирск, 2011. – 34 с.
12. Хасанов А. Г. и др. Разработка и применение имплантантов на основе гликозаминогликанов и комплексов метиленового синего в хирургии. – Уфа, 2005. – 213 с.
13. Чайковская Е. А., Персагашвили Е. З. Гиалуроновая кислота: гиалуроновая кислота: биологический контроль над воспалением и ранозаживлением // Инъекционные методы в косметологии. 2011. №4. С. 20-34.
14. Balazs E. A. Патент США №4141973. Ultrapure hyaluronic acid and the use thereof.
15. Brown T. J., Alcorn D., Fraser J. R. Absorption of hyaluronan applied to the surface of intact skin // J. Invest. Dermatol. 1999. V. 113. №5. P. 740-746.
16. Campo G. M., Avenoso A., Campo S. et al. High Molecular size hyaluronan differently modulates toll-like receptor-4 in LPS-induced inflammation in mouse chondrocytes // Biochimie. 2010. №92, 2. С. 204-215.
17. Holmes M. W. A., Bayliss M. T., Muir H. Hyaluronic acid in human articular cartilage. Age-related changes in content and size // Biochem J. 1988. №250. С. 435-441.
18. Stern R. Hyaluronan catabolism: a new metabolic pathway // Eur j cell boil. 2004. August. №83 (7). Р. 317-25.
19. Yasuda T. Hyaluronan inhibits cytokine production by lipopolysaccharide-stimulated U937 macrophages through down-regulation of NF-kappaB via ICAM-1 // Infl amm Res. 2007. №56, 6. Р. 246-253.
Поступила 11:07.2018
Координаты для связи с авторами:
197101, г. Санкт-Петербург, Петроградская наб., д. 44
E-mail: ekaterina.loboda@gmail.com
Просмотрено 21918  Нравится 14
Нравится 14 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Мне нравится
Мне нравится ![]()
 Наш канал
Наш канал